 14/06/2022, por Erika Yamamoto - A terapia celular CAR-T mostrou-se altamente eficaz no tratamento de alguns tipos de câncer de sangue, como linfoma e leucemia linfoide aguda. A partir da esquerda] O diretor da Faculdade de Medicina, Tarcisio Eloy Pessoa de Barros Filho; o reitor da USP, Carlos Gilberto Carlotti Junior; o presidente do Instituto Butantan, Dimas Covas; o secretário de Ciência, Pesquisa e Desenvolvimento em Saúde, David Uip; o governador Rodrigo Garcia; a secretária de Desenvolvimento Econômico, Zeina Latif; o secretário de Saúde, Jean Gorinchteyn; e o presidente da Fapesp, Marco Antonio Zago. O governador Rodrigo Garcia participou na manhã de hoje, dia 14 de junho, do lançamento do maior programa de tratamento avançado contra o câncer da América Latina. A inovadora terapia celular CAR-T (receptor quimérico de antígeno) utiliza células T para combater o câncer e já se mostrou altamente eficaz no tratamento de linfoma e leucemia linfoide aguda. “O Estado que foi o inovador na vacina, ...
14/06/2022, por Erika Yamamoto - A terapia celular CAR-T mostrou-se altamente eficaz no tratamento de alguns tipos de câncer de sangue, como linfoma e leucemia linfoide aguda. A partir da esquerda] O diretor da Faculdade de Medicina, Tarcisio Eloy Pessoa de Barros Filho; o reitor da USP, Carlos Gilberto Carlotti Junior; o presidente do Instituto Butantan, Dimas Covas; o secretário de Ciência, Pesquisa e Desenvolvimento em Saúde, David Uip; o governador Rodrigo Garcia; a secretária de Desenvolvimento Econômico, Zeina Latif; o secretário de Saúde, Jean Gorinchteyn; e o presidente da Fapesp, Marco Antonio Zago. O governador Rodrigo Garcia participou na manhã de hoje, dia 14 de junho, do lançamento do maior programa de tratamento avançado contra o câncer da América Latina. A inovadora terapia celular CAR-T (receptor quimérico de antígeno) utiliza células T para combater o câncer e já se mostrou altamente eficaz no tratamento de linfoma e leucemia linfoide aguda. “O Estado que foi o inovador na vacina, ...
agora, continuará sendo inovador no combate ao câncer. Esse é o resultado da ciência, da pesquisa, do desenvolvimento e do esforço de todos. É por isso que São Paulo é São Paulo”, ressaltou o governador. Embora já seja aplicada em alguns países, a terapia celular tem como maior obstáculo o custo elevado, que pode chegar a US$ 500 mil por aplicação em cada paciente. No Brasil, o estudo vem sendo desenvolvido pelo Instituto Butantan, em parceria com a USP e Hemocentro de Ribeirão Preto, sob supervisão da Secretaria de Ciência, Pesquisa e Desenvolvimento em Saúde do Estado.
“Curar uma pessoa que estava em situação quase terminal é uma emoção indescritível. Estes dois centros são fruto de anos de dedicação de uma grande equipe. Somos mais de 50 pesquisadores trabalhando há décadas em um único objetivo. O nosso foco é tratar e garantir a vida das pessoas”, destacou Dimas Covas, presidente do Instituto Butantan e coordenador do estudo.
Núcleos de Terapia Celular
Para ampliar o estudo e a aplicação da terapia celular CAR-T, dois novos centros de saúde estão sendo inaugurados: o Núcleo de Terapia Celular e Molecular (Nucel), localizado na Cidade Universitária, e o Núcleo de Terapia Avançada (Nutera), em Ribeirão Preto. Os núcleos terão capacidade inicial para tratar até 300 pacientes por ano.
“Nosso desafio é possibilitar que a terapia seja disponibilizada pelo SUS, fazendo com que o conhecimento produzido nas universidades possa beneficiar a todos. O avanço tecnológico só é possível por causa do conhecimento acumulado após anos de investimentos em pesquisa realizados pelo Estado de São Paulo”, afirmou o reitor da USP, Carlos Gilberto Carlotti Junior.
Os dois núcleos vão contar com estruturas que permitirão que os principais processos da nova tecnologia – produção, desenvolvimento, armazenamento e aplicação da terapia celular – sejam efetuados em solo paulista. O objetivo é reduzir ao máximo o custo em larga escala da terapia e fazer com que ela chegue ao Sistema Único de Saúde (SUS). As instalações incluem laboratórios de controle de qualidade, salas de criopreservação, salas de produção de vírus, salas limpas de produção de células CAR-T, salas de preparo de meios e soluções e áreas destinadas ao armazenamento do produto final e dos insumos em tanques criogênicos.
Terapia celular CAR-T
A terapia celular CAR-T foi desenvolvida no Centro de Terapia Celular da Faculdade de Medicina de Ribeirão Preto (FMRP). O primeiro voluntário, que recebeu o tratamento experimental há dois anos, alcançou a remissão total de um linfoma em estágio terminal. Outros pacientes que optaram pelo tratamento também tiveram remissão.
“Trata-se de uma terapia revolucionária e individualizada, que usa as células de defesa do próprio paciente para combater o câncer. Com esse novo programa, São Paulo reforça seu pioneirismo na pesquisa e na oferta de tratamentos inovadores, de altíssima complexidade, aos brasileiros”, afirmou o secretário de Ciência, Pesquisa e Desenvolvimento em Saúde, David Uip.
Como a terapia celular ainda está em fase experimental no Brasil, os pacientes foram tratados até agora de forma compassiva – por decisão médica, quando o câncer está em estágio avançado e não há outra alternativa de terapia. Esse tipo de pesquisa ainda não influencia uma possível aprovação final do tratamento pela Agência Nacional de Vigilância Sanitária (Anvisa), mas fortalece a possibilidade de aprovação de um estudo clínico com mais voluntários.
Como funciona
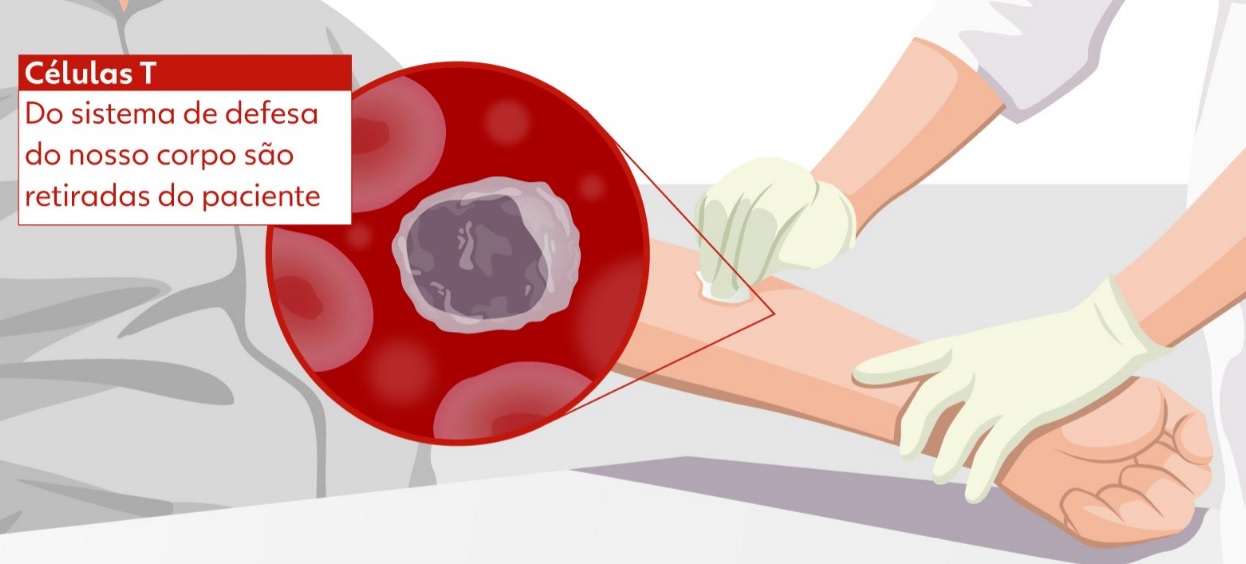
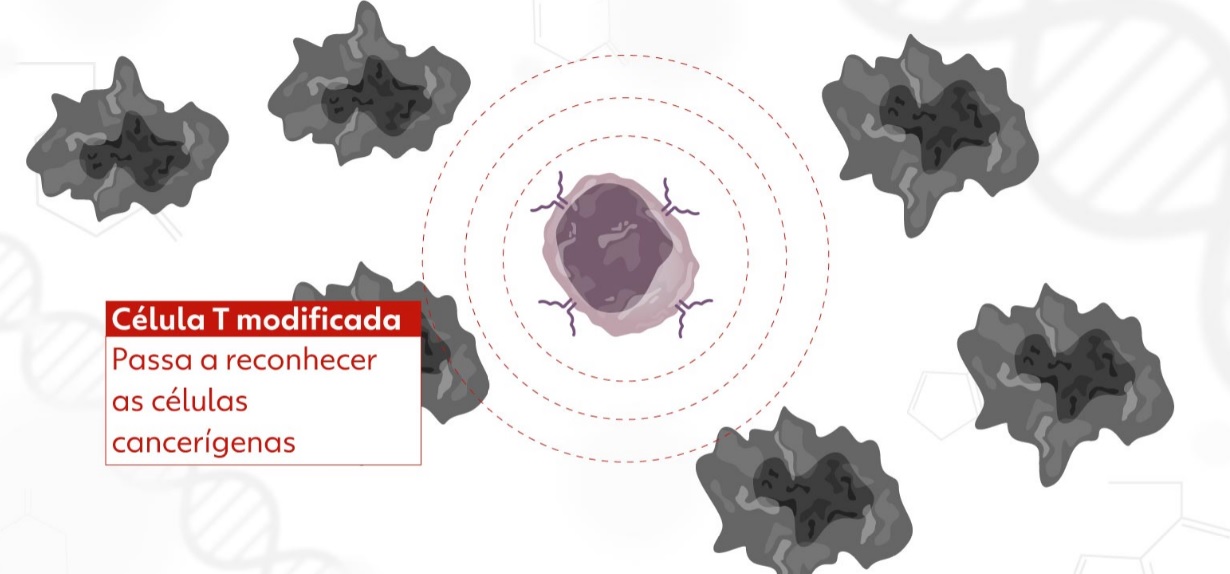
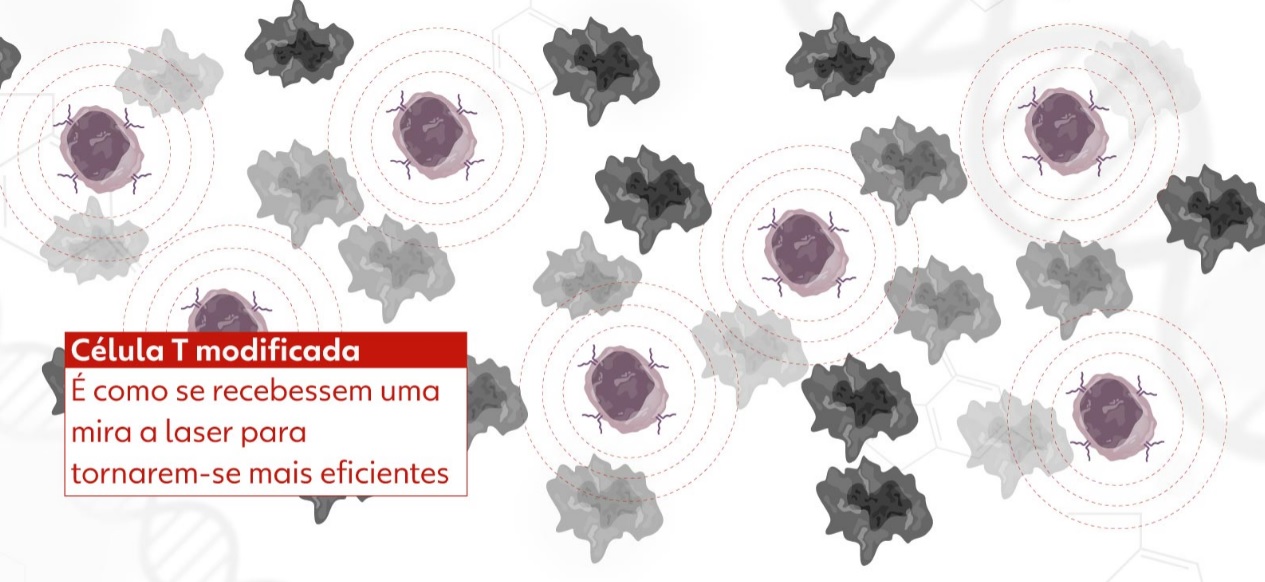
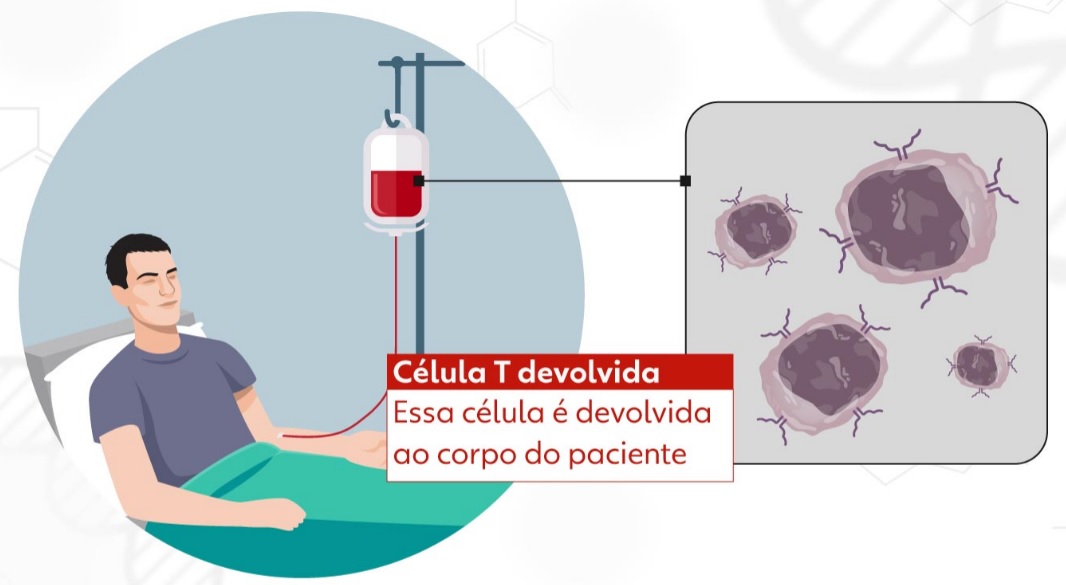
A tecnologia celular CAR-T é um tipo de imunoterapia que utiliza linfócitos T, células do sistema imune responsáveis por combater agentes patogênicos e matar células infectadas. O tratamento consiste em retirar e isolar os linfócitos T do paciente, ativá-los, “reprogramá-los” para conseguirem identificar e combater o câncer e depois inseri-los de volta no organismo do indivíduo. Assim, as células de defesa voltam com mais força para eliminar as células tumorais. Todo o processo pode durar cerca de dois meses.
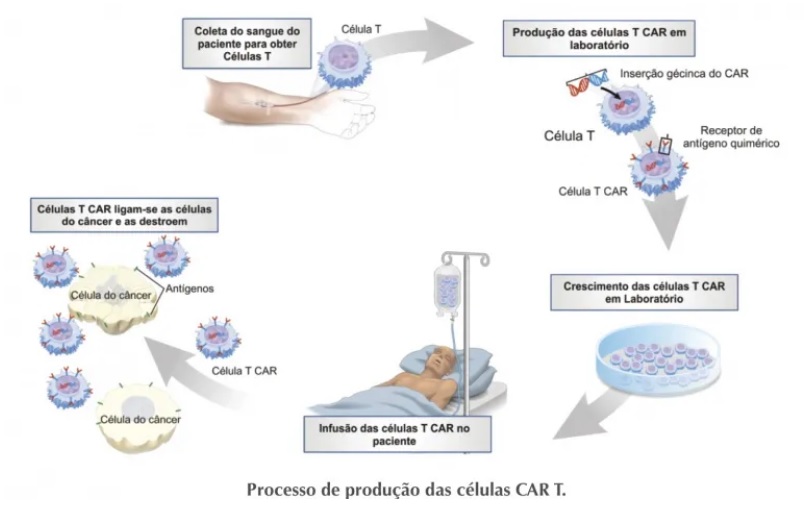
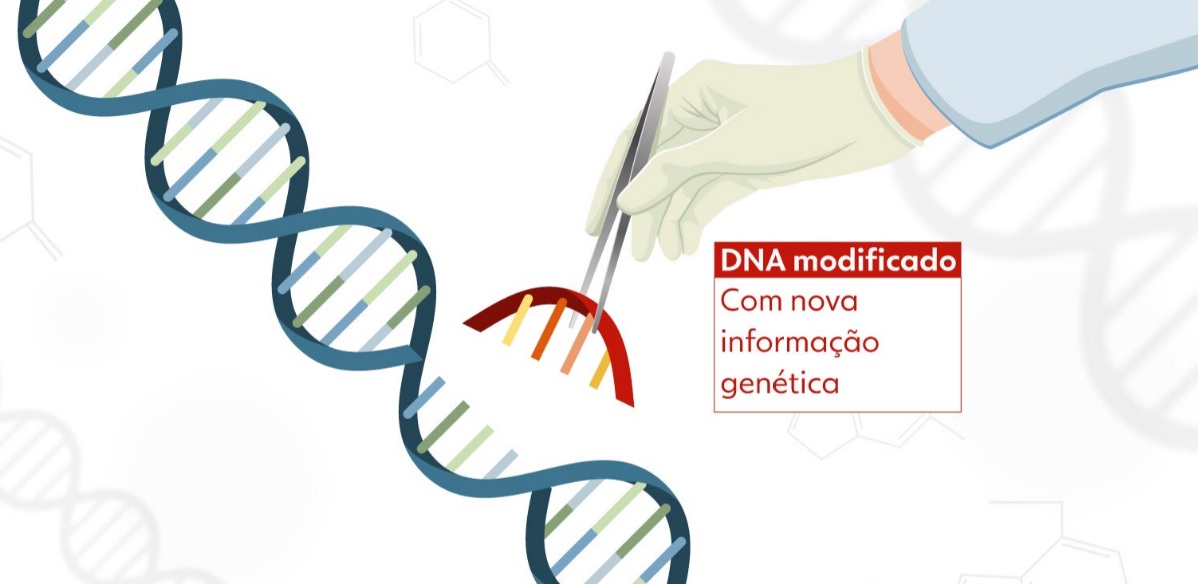
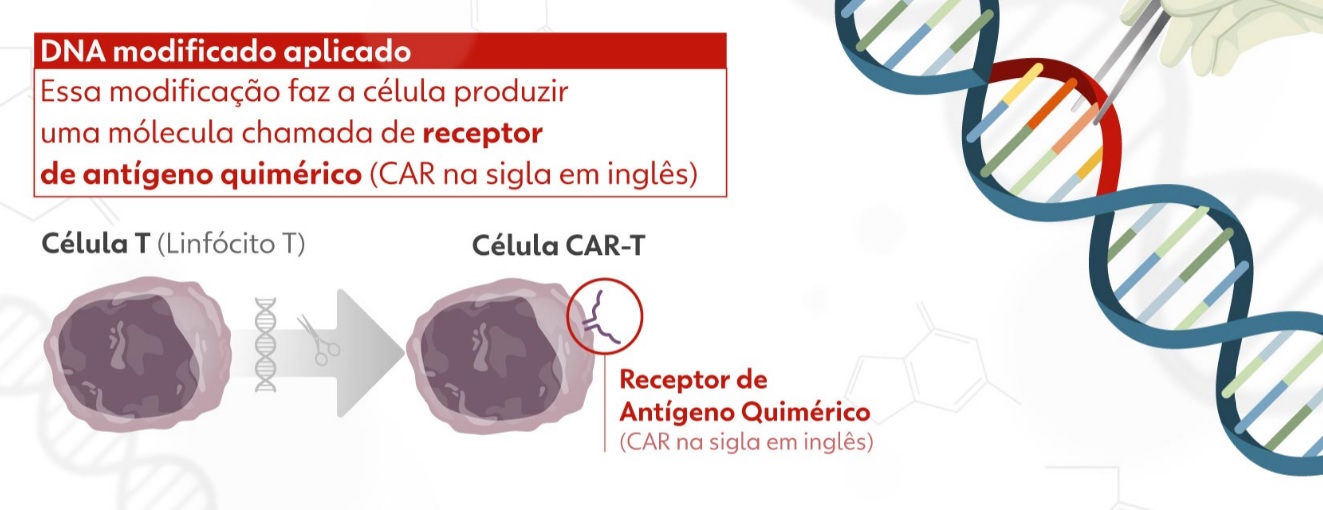
Após a coleta do sangue, a amostra passa por um processo de separação para selecionar apenas o grupo celular de interesse – ou seja, as células T. Depois, os pesquisadores aplicam, em laboratório, um reagente que estimula a ativação dessas células. Com os linfócitos T ativados e multiplicados, eles são colocados em contato com um vetor viral de lentivírus modificado, incapaz de causar doença. O vetor contém a informação genética de um receptor que identifica e se liga ao antígeno CD-19, o mesmo presente na superfície das células tumorais de neoplasias hematológicas.
Por conter a informação genética do receptor do CD-19, o vetor faz a célula T expressá-lo em sua superfície, originando as células CAR-T que serão usadas na terapia. O produto é congelado e passa por rigorosos testes de controle de qualidade antes de ser aplicado em um processo semelhante à transfusão de sangue. De volta à corrente sanguínea, esse conjunto de células CAR-T reconhece e se liga às células do câncer, induzindo à morte celular.
Hemocentro RP e Instituto Butantan vão desenvolver projeto-piloto para o combate ao câncer

16/01/2023 - Combate ao câncer avança com projeto piloto no Hemocentro RP e Instituto Butantan. O combate às leucemias e aos linfomas avança com a decisão da Anvisa em autorizar o projeto piloto que prevê o desenvolvimento de produtos de terapia avançada para o tratamento desses tipos de câncer utilizando as células CAR T. As pesquisas vão acontecer no Hemocentro, de Ribeirão Preto, e no Instituto Butantan, em São Paulo. A terapia é um dos tratamentos mais avançados da ciência no combate ao câncer e já se mostrou capaz de causar remissão da doença. As células de defesa do paciente são modificadas em laboratório para aprender a eliminar a patologia. Depois, são recolocadas no organismo, potencializando o combate natural do corpo contra a leucemia ou o linfoma.
O diferencial da iniciativa é o foco total na disponibilização do produto final para a população brasileira pelo SUS, já que em instituições privadas este tipo de tratamento pode chegar a mais de 1 milhão de reais. Esse é o objetivo do Programa de Terapia Celular, iniciativa da Fundação Hemocentro de Ribeirão Preto, do Butantan, da Faculdade de Medicina da Universidade de São Paulo (FMUSP) e da Faculdade de Medicina de Ribeirão Preto (FMRP-USP). Os estudos serão realizados pelos centros Nutera – Ribeirão Preto e Nutera – São Paulo. Esses dois núcleos serão as primeiras instalações a produzir a terapia CAR-T em escala totalmente no Brasil.
Doença – De acordo com o Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA), vinculado ao Ministério da Saúde, só em 2022 foram diagnosticados mais de 10 mil casos novos de leucemia, sendo 5.920 em homens e 4.890 em mulheres. Atualmente, essa doença ocupa a 9ª posição nos tipos de câncer mais comuns em homens e a 11ª em mulheres. Em relação aos linfomas, um estudo do Observatório da Oncologia identificou mais de 90 mil casos da doença entre 2010 e 2020, prevalecendo o linfoma não-Hodgkin (74%), e um aumento de 26,8% de óbitos entre 2010 e 2019. O levantamento observou que o número de casos de linfoma não-Hodgkin duplicou nos últimos 25 anos, especialmente no grupo etário acima de 60 anos.
Projeto – O principal objetivo da Anvisa na implantação do projeto-piloto é promover suporte regulatório aprimorado e intensificado aos desenvolvedores nacionais de forma a contribuir e acelerar o processo de desenvolvimento destes produtos, por meio de uso e experimentação de ferramentas regulatórias disponíveis e inovadoras para controle de riscos, avaliação de benefícios e de comprovação de segurança, eficácia e qualidade de PTA.
A premissa é a busca por estratégias de otimização para o alcance de altos padrões de segurança, eficácia e qualidade dos produtos investigacionais para atender as necessidades dos pacientes brasileiros em tempo oportuno, com a perspectiva de impulsionar ao desenvolvimento e a aprovação destas terapias avançadas de forma célere, ampliando as oportunidades e criando um mercado competitivo. Segundo a Anvisa, os produtos de terapia avançada, considerados medicamentos especiais e nova fronteira biotecnológica da medicina, são baseados em genes, tecidos ou células e podem oferecer opções de tratamento inovadoras para os pacientes.
Paciente com câncer há 13 anos tem remissão completa em SP em um mês após terapia celular em estudo na rede pública
29/05/2023, por Carlos Henrique Dias - Terapia combate a doença com células de defesa do paciente modificadas em laboratório e é estudada para três tipos de cânceres: leucemia linfoblástica B, linfoma não Hodgkin de células B e mieloma múltiplo. Um protocolo adotado pela Universidade de São Paulo (USP), em parceria com o Instituto Butantan e o Hemocentro de Ribeirão Preto, está trazendo para a rede pública de saúde uma técnica considerada revolucionária no combate ao câncer, utilizada em poucos países.
Até agora, 14 pacientes foram tratados com o CAR-T Cell com verbas da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) e do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). Todos os pacientes tratados tiveram remissão de ao menos 60% dos tumores. A recuperação foi no Sistema Único de Saúde (SUS). Um deles é Paulo Peregrino, de 61 anos, que lutava contra o câncer havia 13 anos e estava prestes a receber cuidados paliativos quando foi submetido ao tratamento em abril e, em apenas um mês, teve remissão completa do seu linfoma.
No segundo semestre, 75 pacientes devem ser tratados com o CAR-T Cell com verba pública após autorização da Anvisa para o estudo clínico. Atualmente, o tratamento só existe na rede privada brasileira, ao custo de ao menos R$ 2 milhões por pessoa. O método tem como alvo três tipos de cânceres: leucemia linfoblástica B, linfoma não Hodgkin de células B e mieloma múltiplo, que atinge a medula óssea. O tratamento contra mieloma múltiplo ainda não está disponível no país.
"Devido ao alto custo, este tratamento não é acessível em grande parte dos países do mundo. O Brasil, por outro lado, encontra-se em uma posição privilegiada e tem a rara oportunidade de introduzir este tratamento no SUS em curto período de tempo", diz Dimas Covas, coordenador do Centro de Terapia Celular CEPID-USP e do Núcleo de Terapia Celular do Hemocentro de Ribeirão Preto, que desenvolveu a versão brasileira dessa tecnologia.
Remissão completa em curto período
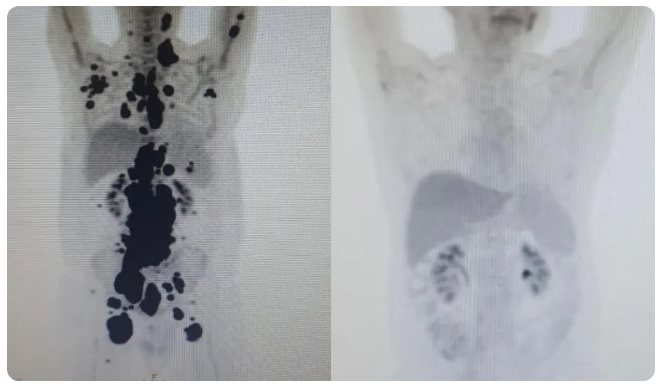
Paulo é o caso mais recente de remissão completa em curto período de tempo do grupo de estudos com os 14 pacientes do Centro de Terapia Celular. Ele teve alta no domingo (28) depois de ficar sob cuidados médicos no Hospital das Clínicas da cidade de São Paulo. Vanderson Rocha, professor de hematologia, hemoterapia e terapia celular da Faculdade de Medicina da USP e coordenador nacional de terapia celular da rede D’Or, está à frente do caso de Paulo.
“Foi uma resposta muito rápida e com tanto tumor. Fico até emocionado [ao ver as duas ressonâncias de Paulo]. Fiquei muito surpreso de ver a resposta, porque a gente tem que esperar pelo menos um mês depois da infusão da célula. Quando a gente viu, todo mundo vibrou. Coloquei no grupo de professores titulares da USP e todo mundo impressionado de ver a resposta que ele teve”, comemorou o especialista.
Entre os outros 13 pacientes tratados como Paulo, 69% tiveram remissão completa em 30 dias. O primeiro paciente tratado com a técnica na rede pública do Brasil teve resultados parecidos com os de Paulo, mas morreu por um acidente doméstico em casa. Antes e depois. As duas imagens do Pet Scan (tomografia feita com um contraste especial ) (veja acima) representam “dois Paulos”: a da esquerda, o paciente que tinha como caminho único os cuidados paliativos, quando a alternativa é dar conforto, mas já sem expectativa de cura, e a da direita, um paciente com um organismo já sem tumores após o tratamento com CAR-T Cell.
Atualmente, o procedimento no Centro de Terapia Celular é feito de forma compassiva, quando o estudo aceita o paciente em estágio avançado da doença, e os médicos conseguem com a Anvisa a autorização para a aplicação do método. Quando o médico teve contato com Paulo, o publicitário já havia passado por procedimentos cirúrgicos, dezenas de exames e quimioterapia.
“A vitória não é só minha. É da fé, da ciência e da energia positiva das pessoas. Cada uma delas ajudou a colocar um paralelepípedo nesse caminho. A imagem prova com muita clareza para qualquer pessoa a gravidade do meu linfoma, e eu não tinha ideia de que era assim”, contou o paciente.
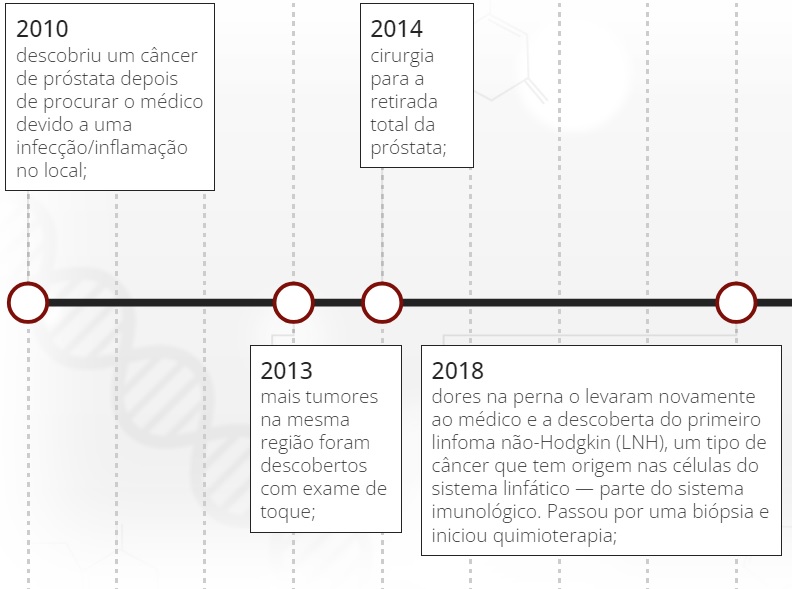
13 anos 'tocando em frente'
Uma linha do tempo ajuda a nortear as idas e vindas dos tumores de Paulo. A trajetória será contada em uma autobiografia ainda em produção intitulada "A Vida pelo Copo D'água", em que ele cita seu remédio: "fé e ciência para viver a metade cheia da vida".
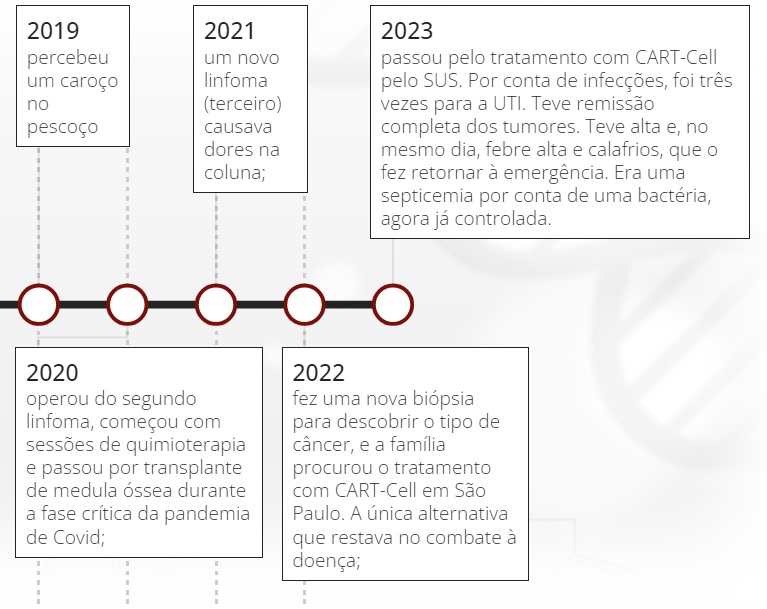
O publicitário mora com a mulher e o filho, de 29 anos, em Niterói, no Rio de Janeiro. A família é de Recife, mas se mudou para o Sudeste na década de 70. Ele é o caçula entre 10 irmãos. Foi o primeiro a enfrentar a doença. Em 2018, quando começou a tratar o primeiro linfoma, os dias se dividiam entre o trabalho, a quimioterapia e as partidas de vôlei de praia. Chegou a jogar um campeonato nas areias cariocas.
“O médico me disse que eu era o primeiro paciente que fazia um esporte de alto rendimento fazendo quimioterapia. Falei: 'O esporte é de alto rendimento, mas meu vôlei, não'”, brincou.
Livro no leito e cegueira temporária
Em 2020, a pandemia de Covid isolou Paulo num quarto de hospital. Ele tinha passado por um transplante de medula óssea. Sem acompanhantes, sozinho, no entanto, não ficou. Pediu à enfermeira os contatos dos pacientes de quartos vizinhos e criou um grupo por WhatsApp, o “TMO Juntos” (trocadilho de "transplante de medula óssea" com TMJ de "tamos juntos”). O grupo era formado por ele, um idoso com a esposa e uma adolescente de 17 anos, que dividiram histórias, se motivaram e trocaram músicas durante o isolamento.
Dentro dos 30 dias, Paulo fez o pré-lançamento de "Brizola e eu", um livro “banhado” a álcool e autógrafos. O esquema era: a esposa entregava os exemplares à enfermeira, o álcool higienizava os livros, ele assinava, e os exemplares eram levados para amigos e parentes.
O livro conta a biografia de Jecy Sarmento, um dos principais assessores e amigos do ex-governador Leonel Brizola. O fim daquele ciclo na internação foi marcado por um bolo levado como surpresa pelas enfermeiras. A contaminação por Covid veio em 2022, durante uma internação devido a uma queda nas plaquetas — quanto menor a contagem delas, maior o risco de sangramento intenso. A tosse forte causou uma hemorragia interna nos dois olhos e uma cegueira temporária de três meses.
“Foi a pior sensação da minha vida. Fui em três médicos e só o terceiro disse: ‘Vamos operar e retirar essa hemorragia do seu olho.”
Mudança de tratamento
Pesquisas na internet levaram a família ao tratamento CAR-T Cell e ao médico Vanderson Rocha.
“Comecei a acompanhá-lo quando já tinha feito uma grande parte do tratamento. A doença voltou, então, a última opção dele realmente era o CAR-T Cell. Tive que pedir autorização da Anvisa pra gente poder fazer esse tipo de tratamento. Muitos pacientes não têm essa oportunidade”, explicou o especialista.
Paulo lembra que teve febre no primeiro dia em que as células modificadas foram aplicadas no corpo, e chegou a ir para a UTI para ser monitorado.
"Senti um pouco de dormência nas mãos, mas tive acompanhamento antes, durante e depois por toda a equipe multidisciplinar do HC, em São Paulo."
Apesar da remissão da doença em um mês, entre março e abril deste ano, Paulo deixou para novembro a “festa da cura”. Por enquanto, ele ficará na capital paulista para acompanhamento.
"A gente só tem duas formas de agradecer à vida: ser resiliente, isso que me impulsionou a chegar até aqui, e fazer o bem para as pessoas", diz ele.
CAR-T Cell no SUS
A produção dessas células é complexa e tem custo elevado, em torno de R$ 2 milhões por paciente, sem contar gastos como internação, segundo Dimas Covas.
O grupo de pesquisa do Centro de Terapia Celular de Ribeirão Preto desenvolveu a versão nacional dessa tecnologia, e, em 2019, foi feito o primeiro tratamento bem-sucedido. Só o Brasil utiliza a técnica em toda a América Latina.
Em 2021, o grupo fez uma parceria com o Instituto Butantan e foram instaladas duas fábricas no estado, uma na Cidade Universitária, em São Paulo, e outra no campus universitário de Ribeirão Preto com a capacidade de produção inicial de 300 tratamentos por ano.
“Para disponibilizar para a população brasileira, é necessário obter financiamento para realizar o tratamento para 75 pacientes com linfoma e leucemia e gerar os dados clínicos que permitam o registro do produto na Anvisa”, explicou Dimas.
“Este estudo clínico custará R$ 60 milhões, mas economizará R$ 140 milhões em relação aos preços praticados pelas empresas privadas. Recentemente, apresentamos o projeto ao Ministério da Saúde e a expectativa é de apoio e financiamento para avançar essa importante tecnologia no país, que poderá iniciar uma nova indústria de biotecnologia”, completou.
A previsão é a de que o estudo comece em agosto deste ano.
“Já tem uma fila de pacientes, porque os médicos que já sabem que nós estamos nesse processo mandam constantemente nomes de pessoas, e esses nomes estão sendo colocados numa fila por requisitos.”
O que diz a Anvisa
A Agência afirmou ao g1 que tem dado prioridade às análises do estudo.
“A Anvisa recebeu proposta de ensaio clínico conduzida pelo CEPID-FAPESP-USP e este pedido está em análise pela Anvisa. O pedido faz parte de um projeto-piloto em que a Anvisa, selecionou o Centro de Terapia Celular (CEPID-FAPESP-USP) de Ribeirão Preto para colaboração no desenvolvimento de produtos de terapia avançada no Brasil. Assim, a Agência tem feito interlocução com a equipe de desenvolvimento do CEPID-FAPESP-USP para aprimorar o desenho do estudo. O CEPID-FAPESP-USP também estabeleceu um cronograma com a Anvisa para enviar informações sobre a possível fabricação do produto e os controles aplicáveis nos próximos meses. A Anvisa, por sua vez, tem dado prioridade a estas análises, proporcionando retorno rápido ao desenvolvedor, com o objetivo de priorizar a execução desse estudo no Brasil."
Como funciona a técnica
A produção da terapia tem início com a coleta dos linfócitos de defesa do tipo T do paciente, que são como "soldados" do sistema imunológico, e que são levados para o laboratório e modificados geneticamente. Essas células são modificadas geneticamente para reconhecer o câncer, são multiplicadas em milhões e devolvidas ao paciente, onde circulam, encontram e matam o tumor sem afetar as células normais. As próprias células do paciente são "treinadas" para combater o câncer.

Anvisa autoriza pesquisa clínica com Car-T Cell no Brasil; paciente teve remissão completa de câncer
26/09/2023, por Carlos Henrique Dias - Estudos estão em fase clínica inicial. Objetivo é avaliar a segurança no tratamento de pacientes com leucemia linfoide aguda B e linfoma não Hodgkin B, recidivados e refratários, em casos de reaparecimento da doença. A Anvisa autorizou a Fundação Hemocentro de Ribeirão Preto (FUNDHERP), em parceria com o Instituto Butantan, a realizar o ensaio clínico no Brasil com o CAR-T Cell, a técnica que combate o câncer no sangue com as próprias células de defesa do paciente modificadas em laboratório. Oitenta e um pacientes passarão pelo estudo.
Segundo a Anvisa, os estudos estão em fase clínica inicial. O objetivo é avaliar a segurança e a eficácia no tratamento de pacientes com leucemia linfoide aguda B e linfoma não Hodgkin B, recidivados e refratários, em casos de reaparecimento da doença ou de resistência ao tratamento padrão. Segundo Dimas Covas, à frente do estudo, nenhum paciente foi escolhido até agora. "O estudo agora vai definir a seleção dos pacientes. Inicialmente em Ribeirão Preto, depois São Paulo e Campinas". Os pacientes precisam entrar em contato pelo e-mail:
"A aprovação desse ensaio clínico é parte de um projeto inovador de colaboração regulatória entre a Anvisa e pesquisadores e desenvolvedores brasileiros. O objetivo é impulsionar o desenvolvimento de produtos de terapias avançadas disponíveis no Sistema Único de Saúde (SUS)", escreveu a agência. A Anvisa e os patrocinadores fizeram reuniões periódicas e discussões de dados e elaboração de documentos técnicos e regulatórios, que foram submetidos continuamente "com inteira dedicação e prioridade por parte da equipe técnica da Agência", afirmou.
Foram 104 dias de avaliação documental realizada pela agência e 144 dias de respostas às exigências trabalhadas pela FUNDHERP. Pacientes, como Paulo Peregrino, que teve remissão total do câncer, passaram pelo tratamento de forma "compassiva", ou seja, por meio de uma autorização da Anvisa, de forma individualizada, para pessoas que já tinham esgotados todos os tratamentos aprovados possíveis.
Como será o estudo?
- Após a aprovação do início do ensaio clínico, a Anvisa criou um plano de acompanhamento.
- Isso envolve revisões frequentes dos dados e informações da pesquisa, com ações planejadas até dezembro de 2024, para monitorar de perto o desenvolvimento do produto.
- Se os resultados forem bons, o objetivo é registrar o produto rapidamente para que as pessoas tenham acesso a uma opção de tratamento segura, eficaz e de alta qualidade disponível no SUS.
- 81 pacientes serão tratados com o produto e serão monitorados no estudo.
- A técnica é utilizada em poucos países. No Brasil, no segundo semestre, os pacientes serão tratados com o CAR-T Cell com verba pública após autorização da Anvisa para o estudo clínico.
Atualmente, o terapia só existe na rede privada brasileira, ao custo de ao menos R$ 2 milhões por pessoa.
CAR-T Cell brasileiro
Desde 2020, ainda segundo a agência, foram registrados no país três produtos de terapia gênica, do tipo CAR-T, para tratamento de leucemias, linfomas e mielomas, e dois produtos de terapia gênica para doenças genéticas raras, desenvolvidos por empresas farmacêuticas biotecnológicas internacionais, mas no sistema privado. Atualmente, cerca de 40 ensaios clínicos com produtos de terapia avançada experimentais estão acontecendo no país, após a aprovação da Anvisa. Um deles está na fase 1, com CAR-T, que também está sendo desenvolvido por pesquisadores brasileiros do Hospital Israelita Albert Einstein, em São Paulo, para tratamento de câncer do sangue.
Primeiros pacientes
Vamberto Luiz de Castro, o primeiro paciente a realizar o tratamento em 2019, teve remissão total, mas morreu pouco tempo depois em um acidente doméstico. Outro caso que repercutiu neste ano foi o do Paulo Peregrino, de Niterói, no Rio de Janeiro, que fez o tratamento de forma compassiva e foi liberado o CAR-T Cell da USP. O publicitário combatia o câncer havia 13 anos e teve remissão completa do linfoma em 30 dias com CAR-T Cell. Paulo estava prestes a receber cuidados paliativos quando, entre março e abril, foi o 14º paciente a ser tratado pela terapia, em São Paulo. Aos 61 anos, Paulo fez as malas e pegou um ônibus de São Paulo a Niterói com a esposa e uma prima dela. O g1 acompanhou as mais de 6 horas de viagem até o momento da chegada na casa.
Carregar as malas sozinho tem um significado importante ao publicitário. Em 2022, ele mal andava e não conseguia colocar o tênis, com o inchaço na perna direita. Na porta, o filho, de 29 anos, esperava o pai. A cadela Aretha estava no quintal e só reconheceu o dono depois de uma cheirada e uma lambida. "Quando você deita assim é porque está reconhecendo. Quando você deixa fazer isso [coçar a barriga] é porque está me reconhecendo", brinca Paulo.
O câncer de Paulo está em remissão. Os especialistas consideram "cura" depois de ao menos cinco anos sem indícios da doença. Renata combatia um linfoma perto do olho esquerdo diagnosticado há um ano. As sessões de quimioterapia até diminuíam temporariamente o inchaço no rosto, mas o câncer continuava. Paulo e Renata se encontraram no hospital:
Vanderson Rocha, professor de hematologia, hemoterapia e terapia celular da Faculdade de Medicina da USP e coordenador nacional de terapia celular da Rede D’Or, está à frente dos casos de Paulo e Renata. "Esses novos tipos de tratamento atualmente reservamos para aqueles casos mais graves, porque não sabemos como vai atuar. É claro que no futuro essa nova terapia poderá ser utilizada numa linha anterior do tratamento", explica o médico.
Paulo - antes e depois
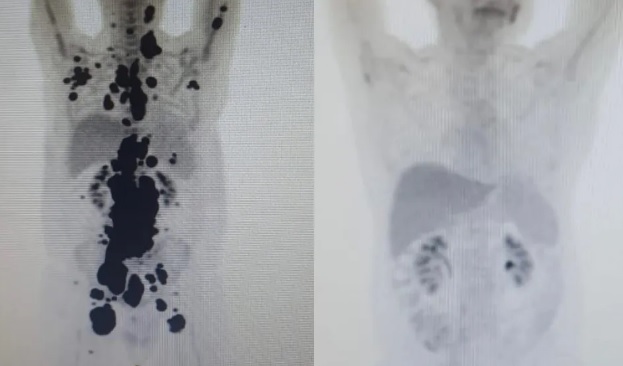
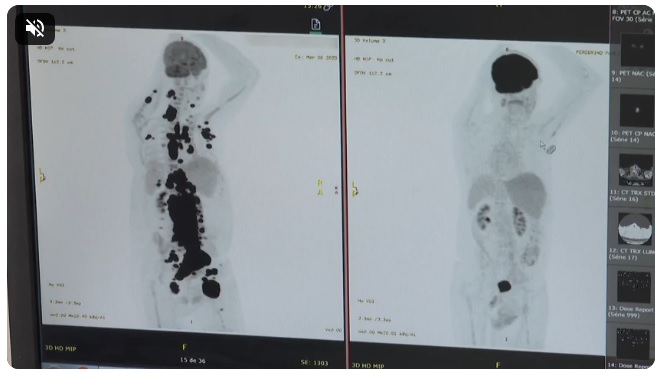
Exames mostram antes e depois de câncer de paciente; à direita, imagem mostra remissão da doença. As duas imagens do Pet Scan (tomografia feita com um contraste especial ) (veja acima) representam “dois Paulos”: a da esquerda, o paciente que tinha como caminho único os cuidados paliativos, quando a alternativa é dar conforto, mas já sem expectativa de cura, e a da direita, um paciente com um organismo já sem tumores após o CAR-T Cell.
“Foi uma resposta muito rápida e com tanto tumor. Fico até emocionado [ao ver as duas ressonâncias de Paulo]. Fiquei muito surpreso de ver a resposta, porque a gente tem que esperar pelo menos um mês depois da infusão da célula. Quando a gente viu, todo mundo vibrou. Coloquei no grupo de professores titulares da USP e todo mundo ficou impressionado de ver a resposta que ele teve”, comemorou Vanderson Rocha, anteriormente sobre os exames de Paulo. Quando o médico teve contato com Paulo, o publicitário já havia passado por procedimentos cirúrgicos, dezenas de exames e quimioterapia. Paulo entrou em remissão da doença em um mês, entre março e abril deste ano.
Fonte: https://jornal.usp.br
https://www.hemocentro.fmrp.usp.br
https://g1.globo.com
