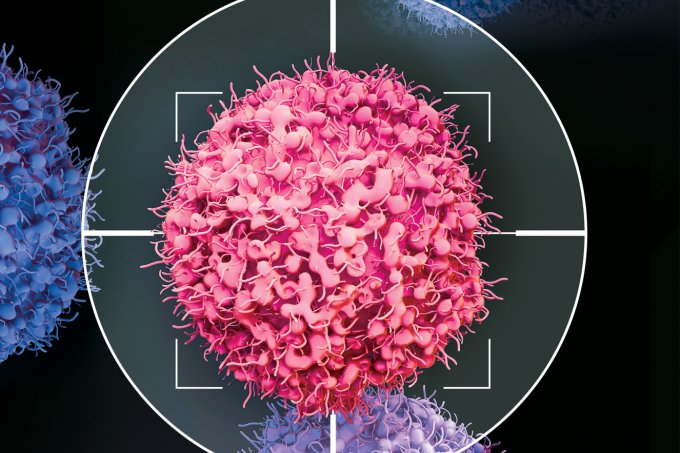
 10/10/2019, por Fabio Manzano - Homem de 64 anos tinha linfoma e tomava morfina todo dia. Pesquisa da USP-Fapesp criou método 100% brasileiro para aplicar técnica norte-americana CART-Cell, que pode custar mais de US$ 475 mil. Vamberto Luiz de Castro, 62, é funcionário público aposentado de BH e sofria de um linfoma terminal. Um paciente de 64 anos que tinha linfoma em fase terminal e tomava morfina todo dia deve receber alta no sábado (12) após ser submetido a um tratamento inédito na América Latina. Ele deixará o hospital livre dos sintomas do câncer graças a um método 100% brasileiro baseado em uma técnica de terapia genética descoberta no exterior e conhecida como CART-Cell.
10/10/2019, por Fabio Manzano - Homem de 64 anos tinha linfoma e tomava morfina todo dia. Pesquisa da USP-Fapesp criou método 100% brasileiro para aplicar técnica norte-americana CART-Cell, que pode custar mais de US$ 475 mil. Vamberto Luiz de Castro, 62, é funcionário público aposentado de BH e sofria de um linfoma terminal. Um paciente de 64 anos que tinha linfoma em fase terminal e tomava morfina todo dia deve receber alta no sábado (12) após ser submetido a um tratamento inédito na América Latina. Ele deixará o hospital livre dos sintomas do câncer graças a um método 100% brasileiro baseado em uma técnica de terapia genética descoberta no exterior e conhecida como CART-Cell.
Os médicos e pesquisadores do Centro de Terapia Celular (CTC-Fapesp-USP) do Hemocentro, ligado ao Hospital das Clínicas de Ribeirão Preto, apontam que o paciente está "virtualmente" livre da doença. Os especialistas, no entanto, não falam em cura ainda porque o diagnóstico final só pode ser dado após cinco anos de acompanhamento. Tecnicamente, os exames indicam a "remissão do câncer".Os pesquisadores da USP - apoiados pela Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) e pelo Conselho Nacional de Pesquisa (CNPq) - desenvolveram um procedimento próprio de aplicação da técnica CART-Cell.
Essa técnica, ainda recente, foi criada nos EUA, está em fase de pesquisas e é pouco acessível. No EUA, os tratamentos comerciais já receberam aprovação e podem custar mais de US$ 475 mil. O paciente submetido ao tratamento no Brasil é o mineiro Vamberto Luiz de Castro, funcionário público aposentado de 62 anos. Antes de chegar ao interior de São Paulo, ele tentou quimioterapia e radioterapia, mas seu corpo não respondeu bem a nenhuma das técnicas.
Leia também - O que é uma Piscina Biológica ?
Em um tratamento paliativo, com dose máxima de morfina, o paciente deu entrada em 9 de setembro no Hospital das Clínicas em Ribeirão com muitas dores, perda de peso e dificuldades para andar. O tumor havia se espalhado para os ossos. O prognóstico de Castro, de acordo com os médicos, era de menos de um ano de vida. Como uma última tentativa, os médicos incluíram o paciente em um "protocolo de pesquisa" e testaram a nova terapia, até então nunca aplicada no Brasil. A CART-Cell é uma forma de terapia genética já utilizada nos Estados Unidos, Europa, China e Japão. Esse método consiste na manipulação de células do sistema imunológico para que elas possam combater as células causadoras do câncer.
Terapia genética
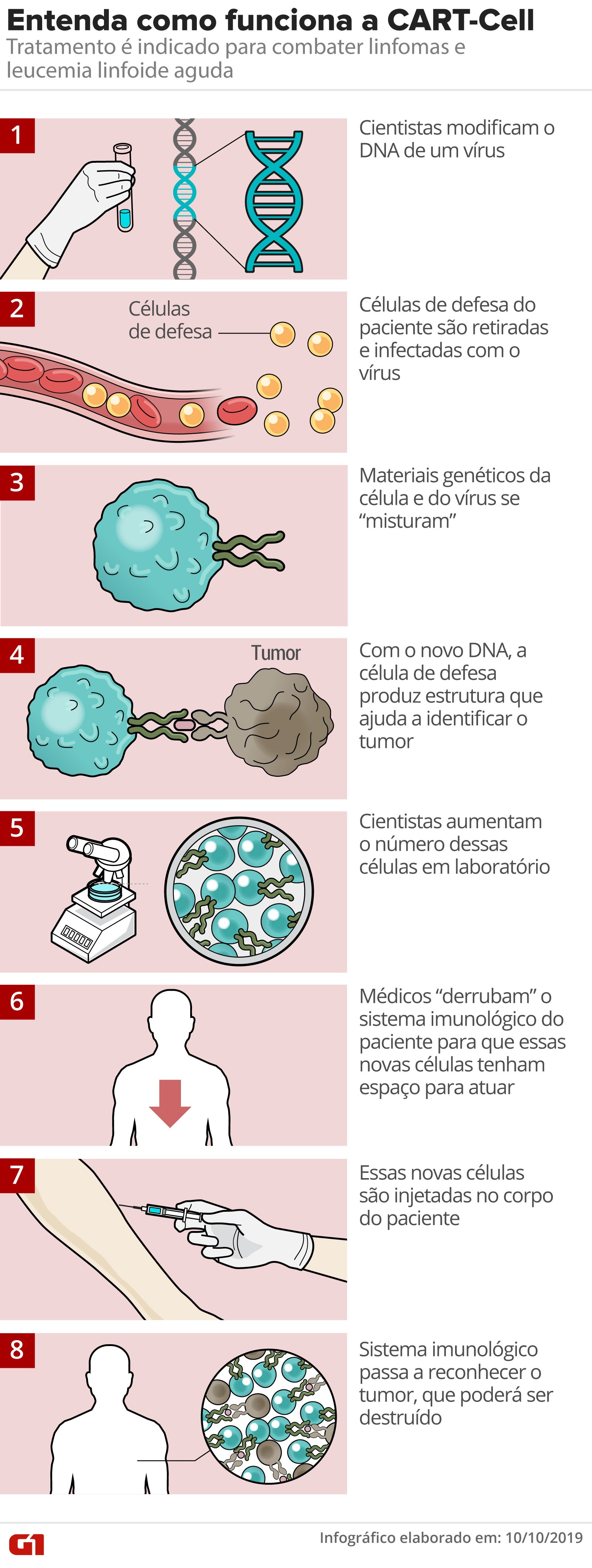
A estratégia da CART-Cell consiste em habilitar células de defesa do corpo (linfócitos T) com receptores capazes de reconhecer o tumor. O ataque é contínuo e específico e, na maioria das vezes, basta uma única dose.
Rápida melhora
Segundo os médicos, Castro respondeu bem ao tratamento e logo após quatro dias deixou de sentir as fortes dores causadas pela doença. Após uma semana, ele voltou a andar.
"Essa primeira fase do tratamento foi milagrosa", disse ao G1 o hematologista Dimas Tadeu Covas, coordenador do Centro de Terapia Celular (CTC-Fapesp) e do Instituto Nacional de Células Tronco e Terapia Celular, apoiado pelo CNPq e pelo Ministério da Saúde.
"Não tem mais manifestação da doença, ele era cheio de nódulos linfáticos pelo corpo. Sumiram todos. Ele tinha uma dor intratável, dependia de morfina todo dia. É uma história com final muito feliz."
100% brasileiro
Renato Luiz Cunha, outro dos responsáveis pelo estudo, explicou que a terapia genética consegue modificar células de defesa do corpo para atuarem em combate às que causam o câncer.
Leia também - Pesquisador cria sistema de irrigação que economiza água e energia em São Paulo / Brasil
"As células vão crescer no organismo do paciente e vão combater o tumor", disse Cunha. "E desenvolvemos uma tecnologia 100% brasileira, de um tratamento que nos EUA custa mais de R$ 1 milhão. Esperamos que ela possa ser, no futuro, acessível a todos os pacientes do SUS." Cunha recebeu, em 2018, o prêmio da Associação Americana de Hematologia (ASH), nos EUA, para desenvolver este estudo no Brasil.

Equipe médica que atendeu ao aposentado Vamberto Luiz de Castro no Hospital das Clínicas de Ribeirão Preto
“É um tratamento caro e que requer um desenvolvimento científico importante”, explica Cunha.
No ano passado a agência norte-americana de vigilância sanitária (FDA), aprovou nos EUA a primeira terapia gênica do mercado para leucemia linfoide aguda. Porém, o tratamento é caro e chega a custar US$ 475 mil dólares. O tratamento ainda não está liberado na rede pública ou privada de saúde, por isso, Cunha explicou que, para o paciente ser atendido no hospital universitário, o encaminhamento foi aprovado por uma comissão de ética.
O hematologista Rodrigo Calado, professor da FMRP-USP e membro do CTC, afirma que “esse tratamento foi possível pelo investimento em pesquisa e formação de pessoas feito pela Fapesp e CNPQ ao longo dos anos e que agora se traduz em um tratamento melhor e mais eficaz em casos de linfomas refratários.”
Perspectivas para o SUS
Dimas Tadeu Covas, que coordena o Centro de Terapia Celular do HC de Ribeirão, disse que o procedimento poderá ser reproduzido em outros centros de excelência do país, mas não dá datas. Isso porque, segundo ele, depende de laboratórios controlados com infraestrutura adequada.
"Devido à complexidade do tratamento, ele também só pode ser feito em unidades hospitalares com experiência em transplante de medula óssea", disse o pesquisador. "Isso porque, durante o processo, a imunidade é comprometida. O paciente tem que ficar isolado, não pode ficar exposto. Não são todos os hospitais que podem fazer esse tipo de tratamento. Além disso a terapia tem efeitos colaterais."
A resposta imune progressiva pode causar febres altas, náuseas e dores musculares. Os pesquisadores não eliminam o risco de morte, e reconhecem que a forte baixa no sistema imunológico traz um potencial fatal para alguns pacientes. De acordo com os envolvidos na pesquisa, antes de o tratamento ser disponibilizado para o Sistema Único de Saúde (SUS), ele precisa cumprir os requisitos regulatórios da Anvisa. O chamada "estudo clínico compassivo" continua e deverá incluir mais 10 pacientes nos próximos 6 meses. Se as etapas de estudos e pesquisas continuarem a se manter promissoras, Covas avalia que o tratamento pode ser adotado em larga escala com adaptações nos laboratórios de produção. “Os investimentos necessários para ampliação da capacidade produtiva são de pequena monta, da ordem de R$ 10 milhões”, afirma Covas.
Car-T Cell é a nova promessa para o tratamento da leucemia e do linfoma
29/11/2019, por Natália Mancini - Recentemente, foi notícia no Brasil todo a cura de um paciente com linfoma, que já estava desenganado e em cuidados paliativos. E o que possibilitou essa importante conquista? Uma nova opção de tratamento que vem sendo estudada por meio da terapia genética conhecida como Car-T Cell. Em fase de testes, a terapia genética ainda não pode ser utilizada por todos os pacientes. Mas é com certeza um grande avanço para a medicina.
O que é o Car-TCell
Na terapia genética, como um todo, é feita a transferência dos genes de uma molécula para outra, para prevenir ou curar uma doença qualquer. No caso da terapia Car-T Cell, é utilizado o linfócito do tipo T, pois é ele que comanda a resposta do corpo aos vírus e ao câncer. O Dr. Eduardo M. Rego, Professor Titular da Faculdade de Medicina da Universidade de São Paulo, Coordenador da Hematologia da Oncologia D’Or e Diretor da Associação Brasileira de Hematologia e Hemoterapia, explica que esse linfócito é retirado do sangue do próprio paciente por meio de um procedimento chamado aférese. Esse método, normalmente, é utilizado para a doação de sangue, mas nesse caso, capta somente o linfócito.
Após o linfócito ser obtido, ele vai para o laboratório e é incubado juntamente com um vírus. Esse vírus tem um gene que produz a proteína Quimérica e ele será transferido para o material genético do linfócito T. Em seguida, o novo gene misturado passa a ser expresso e vai para a superfície do linfócito, onde ele vai atuar. Na parte externa dessa célula produzida em laboratório, encontra-se a molécula com a proteína Quimérica, que tem o papel de reconhecer a célula tumoral. Já na parte interna da célula, há um ativador do funcionamento do linfócito T que combate o tumor.
“Car quer dizer receptor T Quimérico. Isso significa que essa molécula, na sua porção extracelular, é de origem de um gene, e na sua porção intracelular, é de origem de outro gene”, de acordo com o Dr. Rego. Depois que essa modificação do linfócito é realizada, ele precisa ser multiplicado para existir em maior quantidade. Todo esse processo é feito in vitro, ou seja, fora do corpo humano. Uma vez que a quantidade desejada é alcançada, é preciso colocar esse linfócito modificado de volta no paciente, por meio de uma infusão parecida com a doação de sangue.
Leia também - Comer antes de dormir faz mal à saúde?
Quais pacientes podem utilizar a terapia genética Car-T Cell?
De acordo com o especialista, existe um número pequeno de cânceres que podem ser submetidos à terapia com a Car-T Cell. A eficácia desse método depende da existência de um alvo no tumor e do tipo de alvo. Alguns cânceres expressam moléculas que podem ser alvo da terapia, mas elas também podem ser expressadas por tecidos saudáveis. Com isso, aconteceria uma resposta imunológica contra células normais, prejudicando o paciente.
“Por isso que a maioria dos protocolos estão sendo trabalhados para os cânceres hematológicos, como leucemias e linfomas. Os alvos, que são os antígenos, são mais fáceis de serem encontrados nesses cânceres”, diz o médico. Além disso, essa terapia genética está sendo utilizada apenas para casos refratários, aqueles que não respondem ao tratamento proposto. “Muitos dos cânceres em que nós a utilizamos juntamente com anticorpos monoclonais e quimioterapia, o resultado tem sido muito bom. Ela ainda não foi testada como tratamento de primeira linha, mas ainda estamos pesquisando as melhores indicações”, ressalta o especialista.
O primeiro paciente brasileiro a ser submetido ao Car-T Cell, Vamberto Luiz de Castro, se encaixava nessa combinação de fatores. Ele tinha um linfoma não-Hodgkin que expressava um alvo, o CD 19, e não tinha outra alternativa de tratamento. Além disso, a condição dos seus órgãos permitia que ele enfrentasse o tratamento experimental. “Naturalmente, ele autorizou ser submetido a essa terapia genética ciente dos riscos associados, que não são pequenos”, conta o médico. Entretanto, ainda não se sabe quando a Car-T Cell estará disponível para a população no Brasil. Isso acontece devido à falta de infraestrutura para realizar esse procedimento em larga escala e a quantidade de pacientes dentro dos parâmetros.
Somado a tudo isso, é extremamente necessário que o tratamento seja feito em hospitais especializados em transplantes de medula óssea (TMO). Dentre os motivos, estão que os efeitos colaterais desse tratamento podem ser graves. De acordo com o Dr. Rego, o paciente pode sofrer uma síndrome de liberação de citocinas que pode causar um quadro de febre e choque. Além de reações adversas do sistema nervoso central, que podem até levar o paciente ao coma.
Essa terapia genética pode ser considerada a cura para o câncer?
Primeiramente, é preciso lembrar que não existe um único tipo de câncer. Cada tumor é causado devido a um tipo de mutação genética e mesmo dentro de um tipo câncer, existem muitas variações de mutação. Para curar o câncer, o Car-T Cell precisa encontrar as diferenças que sejam mais específicas daquele tumor.
“O câncer é uma doença muito complexa. Penso que a cura vai passar por uma combinação de diferentes tecnologias. Então, nós vamos ter cânceres que serão curados com a quimioterapia tradicional. Dessa forma, amos ter aqueles que serão curados com a imunoterapia, outros com a terapia celular. A cura do câncer ainda é um cálice sagrado, que envolve muitos aspectos ainda deconhecidos”, afirma o Dr.
Há ainda os pacientes que recidivaram mesmo após essa terapia. Isso acontece, particularmente, com pessoas nos Estados Unidos e na China. Uma das explicações é a Teoria da Evolução de Darwin. Ou seja, o câncer desenvolve métodos para não ser destruído, ficando mais forte. De acordo com o especialista, “Toda vez que você coloca uma pressão seletiva, nesse caso seria o próprio Car-T Cell, é possível ter uma adaptação no organismo vivo para a sobrevivência. Então você pode ter a recaída da doença com uma célula que não expressa o antígeno alvo”.
Car-T Cell no Brasil
Apesar de não ter uma previsão para quando essa terapia genética estará disponível no país, existem três brasileiros que devem ser submetidos a ela em breve.
“Calculamos que a nossa capacidade de produzir o vírus e infectar as células linfocíticas de outros pacientes, e a quantidade de vírus que nós temos, deve ser suficiente para mais três pacientes”, detalha o Dr.
Com os resultados obtidos até agora com o Sr. Vamberto Luiz, o novo tratamento tem passado por uma grande procura. Entretanto, os pacientes precisam estar dentro do recomendado para realizar o procedimento. Além da capacidade do Centro de Produção, mencionada pelo especialista, e também da autorização dos órgãos e profissionais responsáveis.
“Aparentemente, todos esses fatores estão indo bem. A expectativa é que completemos essa etapa toda até o final de 2020”, o Dr. Eduardo Rego.
Tratamento que reprograma suas células contra o câncer é testado no Brasil
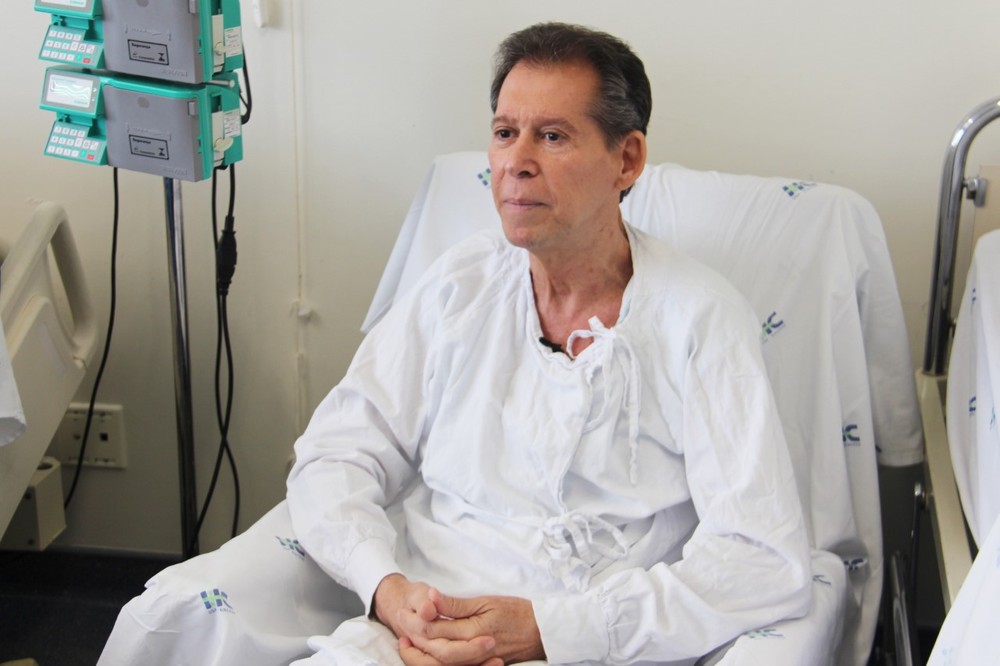
Por Karina Toledo, 19/12/2019 - Células do próprio paciente podem virar uma arma contra o câncer. Uma técnica inovadora que turbina as células de defesa do paciente contra os tumores foi empregada no Brasil pela primeira vez. E obteve bons resultados. Um tratamento inovador contra o câncer conhecido como terapia de células CAR-T, feito com células de defesa reprogramadas do próprio paciente, foi testado pela primeira vez na América Latina por cientistas do Centro de Terapia Celular (CTC) da Universidade de São Paulo (USP) em Ribeirão Preto – um Centro de Pesquisa, Inovação e Difusão (CEPID) apoiado pela Fapesp.
A técnica foi usada para tratar um caso avançado de linfoma difuso de grandes células B – o tipo mais comum de linfoma não Hodgkin, doença que afeta as células do sistema linfático. O paciente, de 63 anos, já havia sido submetido sem sucesso a várias linhas diferentes de quimioterapia desde 2017.
“A expectativa de sobrevida desse paciente era menor que um ano. Para quadros como esse no Brasil, normalmente restam apenas os cuidados paliativos. Contudo, menos de um mês após a infusão das células CAR-T, observamos melhora clínica evidente e até conseguimos eliminar os remédios para dor”, contou Renato Cunha, pesquisador associado ao CTC e coordenador do Serviço de Transplante de Medula Óssea e Terapia Celular do Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto (HC-FMRP-USP).
A terapia de células CAR-T (acrônimo em inglês para receptor de antígeno quimérico) foi inicialmente desenvolvida nos Estados Unidos, onde é oferecida por dois laboratórios farmacêuticos a um preço de 400 mil dólares – sem considerar os gastos com internação. Já a metodologia desenvolvida no CTC tem custo aproximado de 150 mil reais, e pode se tornar ainda mais baixo se o tratamento passar a ser oferecido em larga escala.
“Estamos falando de uma tecnologia muito recente e de uma conquista que coloca o Brasil em igualdade com países desenvolvidos. É um trabalho de grande importância social e econômica”, afirmou Dimas Tadeu Covas, coordenador do CTC e do Instituto Nacional de Ciência e Tecnologia em Células-Tronco e Terapia Celular, apoiado pela Fapesp e pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). O paciente foi atendido na modalidade de tratamento compassivo, que permite o uso de terapias ainda não aprovadas no país em casos graves sem outra opção disponível. O grupo pretende agora iniciar um protocolo de pesquisa com um número maior de voluntários. “Já temos outros dois pacientes com linfomas de alto grau em vias de receber a infusão de células reprogramadas”, contou Cunha.
Como funcionam as células CAR-T
A partir da coleta de sangue dos pacientes a serem tratados, os especialistas isolam um tipo de leucócito (célula de defesa) conhecido como linfócito T. Ele é um dos principais responsáveis pela defesa do organismo graças à sua capacidade de reconhecer antígenos existentes na superfície celular de agentes infecciosos ou de tumores e desencadear a produção de anticorpos. Acontece que o câncer às vezes dribla esse sistema de detecção doenças.
Pois bem: com auxílio de um vetor viral (um vírus cujo material genético é alterado em laboratório), um novo gene é introduzido no linfócito T extraído. Ele então passa a apresentar em sua superfície um receptor (uma proteína) capaz de reconhecer o antígeno específico do câncer a ser combatido.
“Com essa modificação, os linfócitos T são redirecionados para reconhecer e atacar as células tumorais”, explicou Cunha. Mas ainda não acabou. Os leucócitos reprogramados são multiplicados em laboratório e, depois, infundidos no paciente. Antes do tratamento, uma leve quimioterapia é administrada para preparar o organismo.
“Cerca de 24 horas após a infusão das células CAR-T, tem início uma reação inflamatória, sinal de que os linfócitos modificados estão se reproduzindo dentro do organismo e induzindo a liberação de substâncias pró-inflamatórias para eliminar o tumor. Além de febre, pode haver queda acentuada da pressão arterial e necessidade de internação em Unidade de Terapia Intensiva [UTI]. O médico deve ter experiência com a técnica e monitorar o paciente continuamente”, esclareceu. São reações adversas consideráveis, portanto.
O aposentado submetido ao protocolo no HC da FMRP-USP no dia 9 de setembro já superou a fase crítica do tratamento, conseguiu se livrar da morfina – antes usada em dose máxima – e não apresenta mais linfonodos aumentados no pescoço. “Além desses sinais de melhora, conseguimos detectar as células CAR-T em seu sangue e essa é a maior prova de que a metodologia funcionou”, comemorou Cunha. De acordo com o pesquisador, só após três meses será possível avaliar com mais clareza se a resposta à terapia foi total ou parcial – ou seja, se a doença sumiu dos radares ou se foi apenas contida. Os linfócitos reprogramados podem permanecer no organismo pelo resto da vida, mas também podem desaparecer após alguns anos.
Uma vitória brasileira
O projeto que possibilitou a produção das células CAR-T teve início há cerca de quatro anos. Nesse período, foram conduzidos estudos fundamentais sobre as construções virais mais usadas para a modificação gênica, bem como estabelecidos modelos animais para os estudos pré-clínicos. Cerca de 20 cientistas, incluindo médicos e biólogos celulares e moleculares, além de engenheiros especializados em cultivo celular em larga escala, participam do projeto. Mais recentemente, Cunha entrou no time com a experiência clínica e laboratorial adquirida durante estágio realizado no National Cancer Institute, centro pioneiro na técnica.
Leia também - Estudo relaciona Consumo de Leite a Maior Risco de Morte e de Doenças, inclusive dos Ossos
“A metodologia que desenvolvemos é específica para o tratamento de linfoma, mas a mesma lógica pode ser usada para qualquer tipo de câncer. Estamos trabalhando em protocolos para leucemia mieloide aguda e mieloma múltiplo. Também estamos acertando uma parceria com uma universidade japonesa com foco em tumores sólidos, como o de pâncreas”, contou Rodrigo Calado, professor da FMRP-USP e membro do CTC.
O objetivo do grupo, segundo Calado, é desenvolver tratamentos de custo acessível e possíveis de serem incluídos no rol de procedimentos do Sistema Único de Saúde (SUS). “O custo da terapia de células CAR-T é próximo do valor que o SUS repassa para um transplante de medula óssea, hoje em torno de 110 mil reais. Então o tratamento pode ser considerado acessível”, concluiu Calado
Fonte: https://saude.abril.com.br/
http://agencia.fapesp.br/
https://www.abrale.org.br/
https://g1.globo.com/
